|
Пациентам о лекарствах -
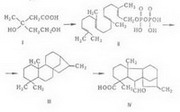
Фармацевтическая субстанция
|
|

Отечественные производители, экспортирующие или планирующие экспортировать фармацевтические субстанции в страны ЕС, должны будут принять стратегическое решение: переходить к соблюдению правил GMP или пересматривать географию зарубежных поставок. В связи с тем, что в Украине принят курс на вступление в ЕС, со временем может затрудниться экспорт и в эту страну.
Принимаемые за рубежом дополнительные меры безопасности против случайных загрязнений сырья, используемого в отрасли, могли бы послужить поводом и отправной точкой для критической оценки действующего в России порядка в данной области. Актуальность проблемы качества фармацевтических субстанций для отечественного рынка лекарств можно проиллюстрировать следующим примером
|
|
Пациентам о лекарствах -
Фармацевтическая субстанция
|
|

Принятие предложений Европейской Комиссии (в случае, если это произойдет) будет иметь следующие последствия:
Фармацевтические производители, т. е. изготовители готовых лекарственных форм, в Евросоюзе и в третьих странах, если они поставляют лекарства с ДЕС, будут обязаны использовать только исходные материалы предприятий, сертифицированные на предмет соблюдения правил GMP. Это требование будет распространяться и на предприятия, расположенные за пределами Евросоюза, но поставляющие исходные материалы в страны ЕС
|
|
Пациентам о лекарствах -
Фармацевтическая субстанция
|
|

В октябре 1994 г. Германия внесла в Комиссию ЕС предложения относительно регулирования качества субстанций, используемых в производстве фармацевтических продуктов. В ответ Комиссия выдвинула (февраль 1995 г.) собственные предложения, касающиеся уже не только фармацевтических субстанций, но исходных материалов , поскольку в документ были включены два вида вспомогательных веществ: желатина и животный жир
|
|
Пациентам о лекарствах -
Фармацевтическая субстанция
|
|

Практика индустриальных стран с отношении лицензирования и инспектирование предприятий по производству активных ингредиентов весьма различна. В США производители субстанций не лицензируются (также как и производители готовых лекарственных продуктов, за исключением биологических), однако они подлежат обязательному инспектированию как минимум через каждые два года. Начиная с середины 1950-х гг., постоянно расширяется практика обследования зарубежных поставщиков активных ингредиентов [13]; ежегодно инспекторы FDA посещают десятки и даже сотни таких предприятий
|
|
Пациентам о лекарствах -
Фармацевтическая субстанция
|
|

В начальный период введения правил GMP (1960-70-е гг.) они применялись лишь к производству дозированных форм из субстанций. В 1980-х гг. общие принципы GMP стали распространяться на предприятия, выпускающие активные ингредиенты, а в дальнейшем и на изготовление вспомогательных веществ
|
|
|
|
<< Первая < Предыдущая 1 2 3 4 5 6 7 8 9 10 Следующая > Последняя >>
|
|
Страница 9 из 10 |