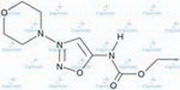
Аптечные новости:
В состав нижегородской ГК Фармассоциация вошла местна Нижегородская аптечная сеть «Фармкомплект-аптека» вошла в состав нижегородской же группы компаний «Фармассоц... |
Российская фармацевтическая ассоциация (Росфарма) Была создана в 1993 году по инициативе и при непосредственном участии фармацевтических работников . В настоя... |
История фармокологии:
История создания лекарств Создание современных лекарственных средств является одним из крупнейших научных достижений XX века. Недаром ... |
История возникновения аспирина Он родился как проявление сыновней любви, чтобы потом положить начало всемирному бизнесу. Старик, больной ар... |
История фармакологии История фармакологии также же продолжительна, как и история человечества. Для облегчения страданий при забол... |
| Элементы международного опыта проведения регистрации лекарственных средств |
| Аптечное дело - Фармацевтический рынок |
|
Создание общеевропейского экономического пространства позитивно отражается во всех сферах обращения лекарств, включая их разработку, производство и потребление. Основное направление развития отечественной государственной системы качества лекарственных средств (ЛС) предполагает ее гармонизацию с системой ЕС. Для решения данной задачи разрабатываются и адаптируются к изменяющимся условиям рекомендации, направленные на усиление контроля качества ЛС и интеграцию в сфере регулирования обращения лекарств. В соответствии с Федеральным законом от 10.06.1998 г. «О лекарственных средствах» №86-ФЗ государственная регистрация является одним из путей государственного регулирования отношений, возникающих в сфере обращения лекарств. Только зарегистрированные лекарственные препараты могут производиться, продаваться и применяться на территории РФ. Порядок и механизм регистрации ЛС в Российской Федерации определяется Административным регламентом Федеральной службы по надзору в сфере здравоохранения и социального развития по исполнению государственной функции по государственной регистрации лекарственных средств, утвержденным приказом Министерства здравоохранения и социального развития РФ от 30.10.2006 г. №736. Административный регламент (далее – Регламент) разработан с учетом международного опыта в области регистрации ЛС. Опыт внедрения правил GMP (Good Manufacturing Practice - надлежащая производственная практика) в России и Украине показал, что те позиции, которые заявлены в регистрационных документах, должны быть обеспечены производственными условиями. Регистрация ЛС в Украине определяется «Порядком государственной регистрации (перерегистрации) лекарственных средств» (далее – Порядок), утвержденным Кабинетом Министров Украины 26 мая 2005 г. Государственная функция регистрации ЛС в РФ исполняется Федеральной службой по надзору в сфере здравоохранения и социального развития с целью допуска лекарств к производству, импорту, продаже и применению на территории России. В Украине государственная регистрация лекарственных препаратов, осуществляемая Министерством здравоохранения, и регламентирует лишь легитимность применения ЛС. Директива 2001/83/ЕС Европейского Парламента и Совета ЕС от 06.11.2001 г. «О своде законов Сообщества в отношении лекарственных препаратов для человека» (далее – Директива) также применяется к лекарственным препаратам, выпускаемым промышленностью и предназначенным для размещения на рынке в государствах-членах ЕС. Подходы российского, европейского и украинского регуляторных документов в определении ЛС, подлежащих государственной регистрации, отличаются. Так, Регламент определяет лекарственные средства, которые необходимо регистрировать (новые ЛС; новые комбинации зарегистрированных ранее ЛС; лекарственные средства, зарегистрированные ранее, но произведенные в других лекарственных формах, с новой дозировкой или другим составом вспомогательных веществ; воспроизведенные ЛС). В Порядке указаны ЛС, не подлежащие государственной регистрации: изготавливаемые в аптеках с использованием разрешенных к применению действующих и вспомогательных веществ по рецептам врачей (магистральным формулам) и по заказу лечебно-профилактических учреждений (официнальным формулам). В Директиве перечень ЛС, не подлежащих регистрации, шире, и кроме указанных выше не регистрируются: Как в России, так и в Украине документом, подтверждающим факт государственной регистрации ЛС, является регистрационное удостоверение. В России срок действия регистрационного удостоверения не ограничен, в то время как в Украине ЛС может применяться только в течение 5 лет со дня его государственной регистрации. Перерегистрация ЛС осуществляется в порядке, определяемом МЗ Украины, с учетом практики стран Европейского союза. Документом, позволяющим вывести лекарственный препарат на рынок государств-членов ЕС, является торговая лицензия, которая обновляется каждые 5 лет по заявке владельца лицензии. Отличаются положения Регламента и Порядка, касающиеся заявителя на регистрацию ЛС. В Украине заявителем может быть как юридическое, так и физическое лицо. В соответствии с российским Регламентом государственная регистрация ЛС осуществляется исключительно на имя юридического лица. При этом заявителем на регистрацию может быть как разработчик, так и другое юридическое лицо (по поручению организации-разработчика ЛС). В соответствии с положениями Директивы ЕС и Порядка в течение всего срока действия регистрационного удостоверения (торговой лицензии) именно заявитель несет ответственность за качество, безопасность и эффективность ЛС, выпущенного на рынок. В Регламенте РФ особо подчеркнуто, что при осуществлении государственной регистрации к российским и зарубежным лекарственным средствам предъявляются одинаковые требования. В Порядке такая ссылка не содержится, что объясняется достаточной степенью гармонизации процедуры регистрации лекарств в Украине с соответствующей процедурой в Европе. В то же время процедура государственной регистрации в Украине отечественных (украинских) препаратов существенно отличается от зарубежных. Различаются сроки, в которые принимаются решения о государственной регистрации ЛС в России, ЕС и Украине. Рассмотрение документов и принятие решения о государственной регистрации лекарств в России осуществляется в срок до 6 месяцев со дня подачи в Росздравнадзор полного комплекта документов, предусмотренных Регламентом. При этом не оговорены ни срок предрегистрационной экспертизы в экспертных организациях, ни время, необходимое на подготовку проекта приказа о регистрации ЛС, выдачу регистрационного удостоверения и включения зарегистрированных лекарств в Государственный Реестр РФ. В то же время в ЕС государства-члены принимают все необходимые меры для того, чтобы процедура выдачи торговой лицензии завершалась в течение 210 дней с момента подачи официально принятой на рассмотрение заявки, включая 30-дневный срок, установленный для принятия решения о регистрации. Такая же по срокам процедура регистрации лекарств действует и в Украине, при этом срок регистрации для препаратов-генериков сокращен до 90 дней. Представляет интерес тот факт, что в соответствии с Директивой ЕС в исключительных случаях по объективным и обоснованным причинам, а также после консультаций с заявителем торговая лицензия может быть выдана при условии соблюдения им особых обязательств. В таком случае после предоставления торговой лицензии заявитель обязан продолжать исследования ЛС и уведомлять обо всех неблагоприятных побочных реакциях. В Регламенте такой порядок выдачи регистрационных удостоверений не предусмотрен. Как в России, так и в Украине процедура государственной регистрации предполагает проведение ряда экспертиз и испытаний качества, безопасности и эффективности ЛС. В Порядке указаны конкретные структуры, осуществляющие экспертизу регистрационных материалов (регистрационного досье) и контроль качества ЛС. Эти процедуры возложены на Государственный фармакологический центр Министерства здравоохранения Украины и Государственную службу лекарственных средств и изделий медицинского назначения. Кроме того, Порядком предусмотрена адаптация регистрационных материалов к стандартам Европейского союза. В России в соответствии с Административным регламентом решение о необходимости экспертизы принимается ответственным исполнителем Федеральной службы, назначаемым начальником отдела, осуществляющего государственную регистрацию ЛС. Экспертиза проводится в соответствии с административным регламентом Федеральной службы по надзору в сфере здравоохранения и социального развития «Организация проведения экспертизы качества, эффективности и безопасности лекарственных средств (при государственной регистрации)», утвержденным приказом Минздравсоцразвития России №734 от 30.10.2006 г. Установленный срок проведения экспертизы – до 130 дней. При этом в Регламенте не прописаны экспертные организации, осуществляющие экспертизу. В Украине же перечень таких организаций утверждается правительством страны. В странах Евросоюза права, обязанности и полномочия всех участников процесса экспертизы четко описаны в законодательных актах ЕС. В регуляторных документах как России, так и ЕС изложены основания, по которым заявителю может быть отказано в регистрации, например, если во время экспертизы регистрационных материалов не подтвердились выводы относительно эффективности, безопасности и качества ЛС или при неполном составе документов и данных, представленных заявителем. В Украине решение об отказе в государственной регистрации (перерегистрации) ЛС по причине некомплектности предоставленных документов не принимается. Однако на практике, если досье не соответствует общепринятым нормам, то оно к рассмотрению не принимается, вне зависимости от того, иностранный или украинский производитель заявляет препарат на регистрацию и кто ходатайствует о его регистрации. Как в России, так и в Украине может быть принято решение о полном или временном запрете на применение ЛС путем прекращения действия регистрационного удостоверения в случае выявления непредвиденных в регистрационных документах неблагоприятных побочных явлений. При этом в соответствии с Директивой ЕС Административный регламент РФ на основании действующих в России правил лабораторной и клинической практики (GLP и GCP) позволяет провести дополнительные доклинические и (или) клинические исследования в связи с выявленными серьезными и (или) непредвиденными побочными эффектами. В настоящее время регистрация одного и того же лекарственного препарата проводится предприятием-производителем в каждой стране СНГ, но и после регистрации выведение препарата на фармацевтический рынок затруднительно из-за таможенных ограничений. Это обусловливает необходимость гармонизации российских требований по регистрации лекарств не только с государствами-членами ЕС, Украиной, но и с другими странами СНГ (Белоруссия, Казахстан и т.д.). Ведущую роль в этом процессе должна сыграть работа Межгосударственной комиссии по стандартизации регистрации и контроля качества ЛС, изделий медицинского назначения и медицинской техники государств – участников СНГ. Регламент РФ определяет, что информация о ходе рассмотрения документов, представляемых на регистрацию ЛС или внесения изменений в регистрационную документацию, должна быть доступна заявителям. Однако в реальности получение заявителем такой информации затруднено, что, несомненно, сказывается на сроках регистрации. Таким образом, анализ основных нормативных документов по регистрации лекарств в России, Украине и странах ЕС показал необходимость приведения российских стандартов в полное соответствие с Директивами ЕС и ICH, что согласуется с требованиями, предъявляемыми к процедуре взаимного признания и гармонизации в сфере лекарственного обращения. |
Почему БАДы:
 Витамины и БАД для поддержания здоровья в преклонном возрастеСтарение организма условно разделяют на нормальное (физиологическое ) старение и преждевременное, которое характеризуется ранним... |
Из каких моментов складывается экспертиза БАД?Поскольку биологически активные добавки производятся на основе нутриентов, которые общеизвестны и достаточно длительное время ... |
Мужские лекарства приносят вред женщинамОказывается большинство рекламируемых лекарств для мужчин ни в коем случае нельзя употреблять женщинам, поскольку в их организме о... |
Больному на заметку:
Каталог лекарств:
Желчегонные средства По механизму действия желчегонные средства принято делить на: средства, усиливающие образование желчи в пече... |
Лечение рака толстой кишки в Израиле комплексным методом Среди основных причин развития онкологии толстой кишки называют несбалансированный рацион питания, с высоким с... |
Ненаркотические анальгетики (обладающие болеутоляющим, жаропонижающим Ненаркотические анальгетики (обладающие болеутоляющим, жаропонижающим и противовоспалительным свойством). - ... |
Препараты для спорта:
Адаптация организма к физическим нагрузкам С биологической точки зрения физическая подготовка представляет собой процесс направленной адаптации орган... |
АМИНОКИСЛОТНЫЕ ПРЕПАРАТЫ И БЕЛКОВЫЕ ПРОДУКТЫ ПОВЫШЕННОЙ БИОЛОГИЧЕСКОЙ Белки являются основным строительным материалом мышечной ткани. Структурными компонентами белков (“Кирпичика... |
Современная спортивная фармакология 1. Повышение спортивной работоспособности спортсменов, т.е. расширение возможностей адаптации (приспособлени... |