Аптечные новости:
В состав нижегородской ГК Фармассоциация вошла местна Нижегородская аптечная сеть «Фармкомплект-аптека» вошла в состав нижегородской же группы компаний «Фармассоц... |
Российская фармацевтическая ассоциация (Росфарма) Была создана в 1993 году по инициативе и при непосредственном участии фармацевтических работников . В настоя... |
История фармокологии:
История создания лекарств Создание современных лекарственных средств является одним из крупнейших научных достижений XX века. Недаром ... |
История возникновения аспирина Он родился как проявление сыновней любви, чтобы потом положить начало всемирному бизнесу. Старик, больной ар... |
История фармакологии История фармакологии также же продолжительна, как и история человечества. Для облегчения страданий при забол... |
| Организация государственного контроля клинических исследований лекарственных средств |
| Фармакология - Клинические исследования |
|
Росздравнадзор осуществляет свою функцию по контролю клинических исследований лекарственных средств, проводя плановые проверки учреждений здравоохранения, аккредитованных на право проведения клинических исследований лекарственных средств. Проверка или инспекция (inspection) согласно терминологии Национального стандарта «Надлежащая клиническая практика» (ГОСТ Р 52379-2005) – это «действие уполномоченных органов, заключающееся в официальной проверке документации, оборудования, иных материалов, имеющих, по мнению уполномоченных органов, отношение к клиническому исследованию и находящихся в исследовательском центре, в помещениях спонсора и/или контрактной исследовательской организации, а также иных организациях, имеющих, по мнению уполномоченных органов, отношение к исследованию» (п. 1.11 раздел «Термины и определения»). Целью контрольных мероприятий Росздравнадзора является оценка организации деятельности учреждения здравоохранения в области клинических исследований лекарственных средств, соблюдение требований действующего законодательства и правил GCP на примере конкретных протоколов исследований. Административными основами, в рамках которых функционирует программа контрольных мероприятий, являются: Постановление Правительства Российской Федерации от 30.06.2004 №323, в котором Федеральная служба наделена полномочиями по контролю за проведением клинических исследований лекарственных средств и выполнением правил клинической практики; планы мероприятий Федеральной службы по контролю, которые составляются ежеквартально с перечнем контролируемых учреждений здравоохранения и сроков выполнения проверки; акт мероприятий по контролю – документ, регламентирующий контрольную деятельность, который был разработан и утвержден приказом Федеральной службы и содержит требования к учреждению здравоохранения как к исследовательскому центру, определяет объем программы проверки.Для проведения проверки формируется комиссия из сотрудников Отдела организации государственного контроля доклинических и клинических исследований лекарственных средств Росздравнадзора и подведомственных организаций. В настоящее время 921 учреждение здравоохранения во всех регионах России заявлено как клинические исследовательские центры, и часть проверок осуществляется силами территориальных органов Росздравнадзора. Лица, проводящие инспекции, имеют право прямого доступа к документам исследования и в обязательном порядке принимают меры предосторожности для соблюдения анонимности испытуемых и конфиденциальности информации. По результатам проверки составляется отчет в виде Акта проверки, завершается контрольное мероприятие встречей с администрацией учреждения здравоохранения и исследователями, на которой обсуждаются выявленные нарушения и выносятся рекомендации по их устранению. Следует подчеркнуть, что проверки Росздравнадзора носят не только контролирующий, но и организационно-методический характер. В рамках государственного контроля за проведением клинических исследований лекарственных средств с 2005 г. Росздравнадзором проверена деятельность 132 учреждений здравоохранения, являющихся клиническими базами исследований в 39 городах Российской Федерации (рис. 1). Поскольку основное количество аккредитованных Росздравнадзором клинических баз сконцентрировано в Центральном и Северо-Западном федеральных округах, наибольшее число контрольных мероприятий (63,4% от общего количества проверок) проведено в Москве, Санкт-Петербурге, Ярославле, Смоленске, Нижнем Новгороде, Казани, Самаре, Воронеже, Ростове-на-Дону, Краснодаре, Челябинске. Проведение клинических исследований лекарственных средств в крупных городах России наиболее привлекательно, т.к. там сосредоточены высококвалифицированные научные медицинские кадры, развита медицинская инфраструктура, обеспечен набор пациентов, нет проблем со средствами коммуникации и доставкой лекарственных средств и материалов исследования. Рассмотрим структуру контрольного мероприятия, аспекты контролируемой деятельности и результаты проверок (рис. 2). Результаты проведенных Росздравнадзором инспекций продемонстрировали, что в целом деятельность в области клинических исследований лекарственных средств осуществляется организациями и учреждениями здравоохранения Российской Федерации надлежащим образом. Нарушений, которые могли бы повлиять на безопасность пациентов, ошибок и фальсификаций, требующих административного вмешательства, выявлено не было. Определенные недостатки и замечания, которые должно устранить в рабочем порядке, были установлены в 30% проверенных учреждениях. Причем все выявленные недочеты носили типичный характер. Представляем детальную характеристику выявленных недостатков по основным разделам проверок. Напомним, что правовой основой проведения клинических исследований в Российской Федерации являются: Замечания к учреждениям здравоохранения по этой части деятельности в основном касались взаимодействия учреждения здравоохранения и образовательного или научного учреждения. Так, договора о сотрудничестве учреждения здравоохранения и образовательного или научного учреждения, расположенного на его базе, носили общий характер, документально не подтверждали факт совместного проведения клинических исследований лекарственных средств, а также не регламентировали распределение прав и обязанностей сторон при осуществлении исследований. Подобные факты чаще наблюдаются в том случае, когда исполнителями клинического исследования являются сотрудники вузов, кафедры которых расположены на базе лечебных учреждений, что создает ситуацию, при которой администрация больницы не знает о том, что пациенты клиники участвуют в исследованиях. Нередко отсутствовали дополнительные к договору документы администрации больницы по проведению конкретного исследования, где должны быть указаны программа исследования, сроки выполнения, назначены ответственные лица, определен состав рабочего коллектива и т.п. |
| Читайте: |
|---|
Почему БАДы:
Укрепление зубовЕсли во рту установлена любая искусственная конструкция, то вопрос гигиены становится еще более актуальным. Протезирование зубов с... |
Проверенное сырье для БАД - залог безопасности препаратаЗдоровье человека напрямую зависит от его образа жизни и питания. Диетологи называют астрономические цифры полезных веществ, к... |
БАДы для стойкого повышения иммунитетаДовольно часто нам приходится слышать о том, что за здоровье человека отвечает иммунитет. Тем не менее, все реже встретишь пол... |
Больному на заметку:
Каталог лекарств:
Кислоты Кислота салициловая , белые мелкие игольчатые кристаллы без запаха. Мало растворимы в холодной воде, раст... |
Окислители Перекись водорода (пергидроль) - выпускается два препарата, представляющие раствор перекиси водорода в во... |
Как выбирать правильно БАДыБиодобавки это нутрицевтики, которые оказывают достаточно положительное влияние на здоровье человека и до... |
Препараты для спорта:
Источник выносливости и силыЕсли вы желаете улучшить ваши способности, пытаетесь увеличить мощность организма, тяжело тренируетесь, т... |
Пластический и энергетический обмены клетки (ассимиляция и диссимиляци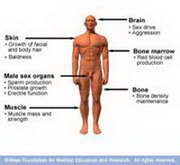 В клетке обнаружены примерно тысяча ферментов. С помощью такого мощного каталитического аппарата осуществляе... |
Основные задачи спортивной фармакологии Последние 10-15 лет характеризуются внедрением в спортивную практику огромного количества фармакологических ... |